北理工課題組在蛋白自組裝領域重要研究進展
發布日期:2023-08-08 供稿:生命學院 攝影:生命學院
編輯:肖雯 審核:周連景 閱讀次數:
近日,北京理工大學霍毅欣教授團隊在蛋白自組裝領域發表重要綜述(https://doi.org/10.1016/j.tibtech.2023.06.009),發表在《Trends in Biotechnology》(影響因子:17.2996)。該工作以北京理工大學為第一通訊單位,副研究員陳振婭為第一作者,霍毅欣教授為通訊作者,博士生毋彤、于盛竹,碩士生李敏、樊泫何為參與作者。
酶自組裝是指目標酶可在蛋白自組裝支架的輔助下聚集形成有序的大分子技術(圖1)。在代謝工程中,自組裝策略已被用于聚集同一途徑中多個酶,以提升多個酶的順序催化效率,進而提升整條途徑的代謝通量,增強目標產物合成效率,實現高水平生產。蛋白自組裝支架的性能對高效穩定的多酶組裝系統的構建至關重要。本文首先分析了代謝工程現階段生產遇到的難題,隨后闡述了自組裝支架在解決代謝工程難題中的應用優勢。隨后,將現有代謝工程領域應用的蛋白自組裝支架進行了分類,并對不同支架的組裝方式進行了綜合分析。接著,闡述了自組裝支架在代謝工程領域不同模塊的應用場景,包括提高單個酶的催化效率,提升多酶級聯的順序催化效率,減少副反應及加強輔因子的供應等。此外,本文分析了現有自組裝支架的不足,闡述了不同支架的組裝性能,提出了針對不同支架的性能改進策略,為高效微生物細胞工廠的構建提供了新思路。
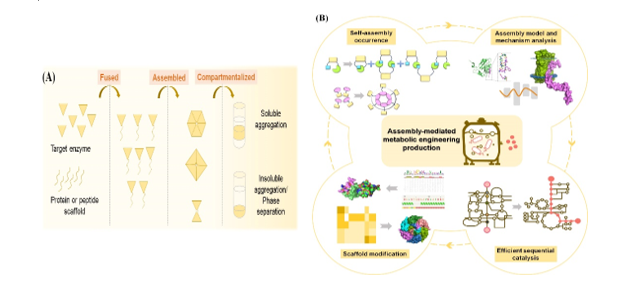
圖1 酶自組裝及自組裝介導的代謝工程生產
上述綜述是對本團隊近年來利用蛋白自組裝支架在代謝流調控方面的開發及應用的總結和分析,相關工作如下:
1. 利用自組裝支架構建新型蛋白固定化方法
體外生物合成因其過程可控及轉化效率高等特點已經成為生產高值化合物的一種極具吸引力的方法。體外生物合成過程中,酶的可重復利用對于節省成本和提高合成效率至關重要。酶固定化是實現酶重復利用的簡單直接方法。簡便易行的酶固定化方法可快速高效實現酶的固定化。基于此,申請人以食品生產香料的重要前體物異丁醛體外生物合成為例,利用CipA的自組裝特性建立了一步自組裝的固定化策略,利用此策略實現了纈氨酸到異丁醛合成途徑相關酶LeuDH和KivD的固定化。結構模擬結果表明,CipA介導的酶固定化不影響目標酶的結構和催化機制(圖2)。與游離酶相比,固定化酶具有更高的轉化能力和熱穩定性。此外,批次轉化實驗表明,使用多輪后回收的固定化酶具有與第一輪反應中固定化酶相近的轉化能力。隨后,通過搭建連續生產裝置,同時將固定化酶裝載到連續生產裝置中,實現了異丁醛的體外連續生產。此項工作不僅拓展了自組裝系統的應用范圍,而且為體外生產高值化合物提供了指導。相關研究成果發表在 Journal of Agricultural and Food Chemistry (影響因子:6.1004)雜志上(In vitro biosynthesis of isobutyraldehyde through the establishment of a one-step self-assembly-based immobilization strategy.)。副研究員陳振婭與碩士生趙璐瑤為共同第一作者,霍毅欣教授與陳振婭副研究員為共同通訊作者。
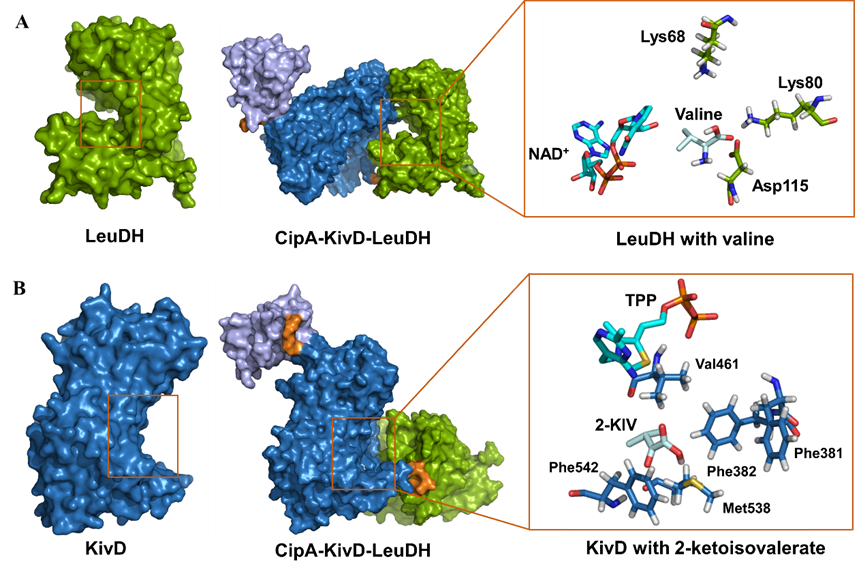
圖2 CipA-KivD-LeuDH與底物的復合物模型
2. 利用自組裝支架重導細胞代謝流
鄰苯三酚是一種具有多種生理功能和藥物價值的酚類化合物。申請人在大腸桿菌中成功構建了以葡萄糖為初始碳源的鄰苯三酚非天然生物合成途徑。在生物合成過程中,關鍵前體物4-羥基苯甲酸先被Y385F/T294A PobA催化生成3,4-二羥基苯甲酸,3,4-二羥基苯甲酸再被Y385F/T294A PobA進一步催化生成沒食子酸,隨后脫羧酶PDC對沒食子酸進行脫羧反應生成鄰苯三酚。脫羧酶PDC的底物多樣性導致其也會對中間產物3,4-二羥基苯甲酸進行脫羧反應,進而生成副產物兒茶酚。在組裝完整途徑并轉化到宿主菌中發酵后發現鄰苯三酚產量很低,副產物兒茶酚產量很高,說明Y385F/T294A PobA催化3,4-二羥基苯甲酸到沒食子酸的過程不夠迅速,導致大量的碳源流向了副產物兒茶酚的生產途徑。于是,申請人借鑒了CipA的自組裝特性,將CipA與合成途徑中的關鍵限速酶Y385F/T294A PobA融合形成融合蛋白(Y385F/T294A PobA-CipA或CipA-Y385F/T294A PobA),隨后融合蛋白在胞內聚集形成包涵體(圖3)。聚集后的Y385F/T294A PobA加快了4-羥基苯甲酸到沒食子酸的兩步轉化,降低了脫羧酶PDC對3,4-二羥基苯甲酸的催化,提高了目標產物鄰苯三酚的產量。相關研究成果發表在 Applied Microbiology and Biotechnology (影響因子:5.0002)雜志上(CipA-mediating enzyme self-assembly to enhance the biosynthesis of pyrogallol in Escherichia coli .)。陳振婭副研究員為通訊作者。

圖3 自組裝聚集Y385F/T294A PobA
3. 基于自組裝支架構建新型蛋白純化方法
常用的傳統蛋白分離純化方法是親和純化,其依賴于對親和層析柱的使用。親和純化的成本高,與大規模生產不適配,同時利用親和純化得到的蛋白帶有純化標簽,而純化標簽會影響靶蛋白活性。因此,為了節省蛋白純化成本,簡化純化步驟,同時使靶蛋白維持原有特性,申請人設計開發了一種自組裝蛋白純化方法,這種蛋白純化方法依賴于一種雙功能純化標簽CipA-DnaB,此標簽同時具有自組裝和自裂解功能,將此標簽與靶蛋白融合即可純化得到無標簽靶蛋白,且靶蛋白能夠保持原有活性。CipA-DnaB標簽是由自組裝蛋白CipA和內含肽蛋白 Ssp DnaB融合得到,其中CipA可自發組裝形成蛋白包涵體, Ssp DnaB是一種在弱酸條件下C端可發生自裂解的短內含肽。將此雙功能標簽與靶蛋白融合后,靶蛋白會在CipA的引導下進行自組裝(圖4),隨后僅需離心和自裂解步驟即可快速純化得到可溶的無標簽靶蛋白。接著,為了提高蛋白純化效率,優化了CipA與 Ssp DnaB之間的連接肽和自裂解條件,結果顯示利用柔性連接肽同時在裂解液中添加EDTA能夠顯著提高蛋白純化效率。為了驗證此自組裝蛋白純化方法的普適性,利用此方法純化了MBP、KivD和AdhP,同時檢測了純化后的KivD和AdhP酶活性,結果顯示純化后的KivD和AdhP仍然具有較高的比酶活。此項工作建立的新型自組裝純化方法可為工業蛋白純化提供一種成本低且有效的選擇。相關研究成果發表在 Journal of Biotechnology (影響因子:4.0998)雜志上。(A novel protein purification strategy mediated by the combination of CipA and Ssp DnaB intein.)副研究員陳振婭與碩士生趙璐瑤為共同第一作者,霍毅欣教授與陳振婭副研究員為共同通訊作者。
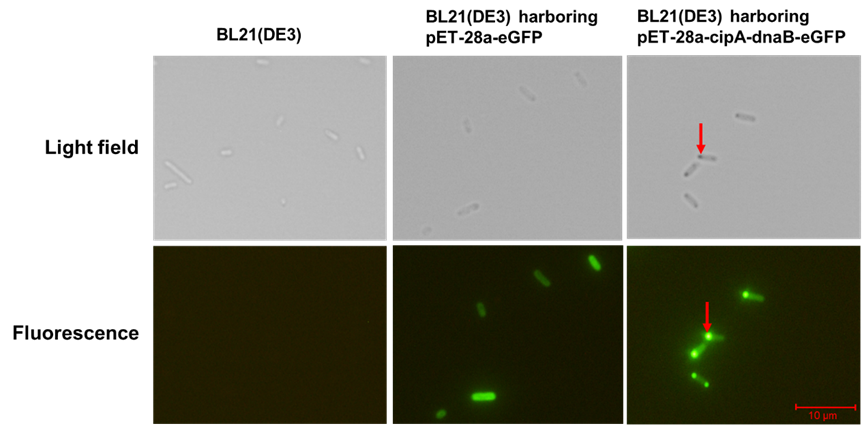
圖4 CipA-DnaB在大腸桿菌中組裝eGFP
該項工作得到了國家自然科學基金和中央高校基本科研業務費專項資金的支持,也感謝北京理工大學生物與醫學工程公共實驗中心的支持。
分享到:
